Die Biotech-Industrie erlebt gegenwärtig eine Renaissance, wurden in den USA 2018 doch so viele neue Therapien zugelassen wie noch nie. Aber es gibt grosse Unterschiede zwischen den Arzneimitteln, sind die Mitglieder im Janus Henderson Global Life Sciences Team überzeugt. Umso wichtiger für Anleger, sich auf die medizinischen Vorzüge und das kommerzielle Potenzial neuer Medikamente zu konzentrieren. Innovation ist einer der Eckpfeiler der Biotech-Branche, die noch nie in einer solchen Fülle bahnbrechende medizinische Entwicklungen hervorgebracht hat wie heute. Aber trotz des damit verbundenen Potenzials sollten Anleger unseres Erachtens Vorsicht bei Engagements im Biotech-Sektor walten lassen. Das
Topics:
investrends.ch considers the following as important: im Fokus, Janus Henderson Investors, NL Fonds im Fokus
This could be interesting, too:
investrends.ch writes Janus Henderson schafft Stelle des Global Chief Operating Officer neu
investrends.ch writes Dividendenkürzungen 2020 weniger gravierend als erwartet
investrends.ch writes Barmittel härter für sich arbeiten lassen
investrends.ch writes Weltweite Dividenden erreichen neuen Rekordstand
Die Biotech-Industrie erlebt gegenwärtig eine Renaissance, wurden in den USA 2018 doch so viele neue Therapien zugelassen wie noch nie. Aber es gibt grosse Unterschiede zwischen den Arzneimitteln, sind die Mitglieder im Janus Henderson Global Life Sciences Team überzeugt. Umso wichtiger für Anleger, sich auf die medizinischen Vorzüge und das kommerzielle Potenzial neuer Medikamente zu konzentrieren.
Innovation ist einer der Eckpfeiler der Biotech-Branche, die noch nie in einer solchen Fülle bahnbrechende medizinische Entwicklungen hervorgebracht hat wie heute. Aber trotz des damit verbundenen Potenzials sollten Anleger unseres Erachtens Vorsicht bei Engagements im Biotech-Sektor walten lassen.
Das Innovationskarussell dreht sich immer schneller
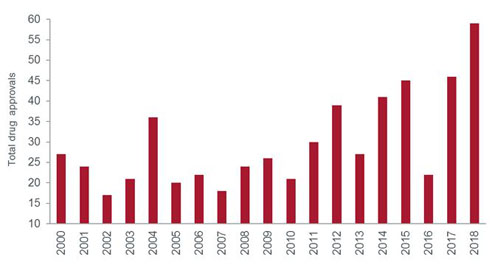
Im Jahr 2018 hat die amerikanische Arzneimittelbehörde FDA 59 neuartige Therapien zugelassen, so viele wie noch nie in einem Jahr (1). Aber auch die Qualität der Arzneimittel war beachtlich: Mit vielen sind erhebliche Fortschritte in ihrer jeweiligen Erkrankungsgruppe verbunden, bei seltenen lebensbedrohlichen Krankheiten ebenso wie bei häufig auftretenden.
Ein gutes Beispiel ist die Migräne, unter der weltweit rund eine Milliarde Menschen leidet(2). Bis vor Kurzem behandelte man mit Mitteln gegen die stechenden Kopfschmerzen lediglich die Symptome dieser neurologischen Erkrankung. Im letzten Jahr erteilte die FDA jedoch erstmals einem Calcitonin-Gen-bezogenen Peptid (CGRP)-Inhibitor die Zulassung. Diese Antikörper blockieren die Bindung von CGRP an einen Rezeptor, der aus Sicht der Forschung eine Schlüsselrolle in der Pathophysiologie der Migräne spielt. In klinischen Studien wurde bei mit diesen Blockern behandelten Patienten eine signifikante Reduzierung der Anzahl der Tage mit Migränesymptomen festgestellt. Oder anders ausgedrückt: Durch die Gabe von CGRP konnte dem Entstehen von Migräne vorgebeugt werden, was eine wesentliche Verbesserung der Lebensqualität für migränegeplagte Menschen bedeutet.
Grafik: Arzneimittelzulassungen der FDA
Quelle: US-Arzneimittelbehörde FDA, Stand: 31. Dezember 2018. Anmerkung: Gesamtzahl der Medikamente stellvertretend für neue Wirkstoffe.
Entgegenkommende Aufsichtsbehörden
Wichtige Schützenhilfe kommt von den Regulierern, die mit einem beschleunigten Zulassungsverfahren derartige Fortschritte unterstützen. Die FDA etwa hat den Status einer Durchbruch-Therapie eingeführt. Er beschleunigt die Überprüfung von Medikamenten, mit denen schwere Erkrankungen behandelt oder die Pflegestandards verbessert werden können. Kürzlich hat die Europäische Arzneimittelagentur EMA das neue PRIME-Programm vorgestellt, mit dem das Zulassungsverfahren für neuartige Präparate um fast ein Drittel verkürzt werden soll. Und schliesslich hat die chinesische Arzneimittelzulassungsbehörde SFDA bei ihrem Zulassungsverfahren erstmals Daten aus klinischen Versuchen zugelassen, die nicht in China durchgeführt wurden. Dies ermöglicht nicht nur eine schnellere Markteinführung, sondern auch eine deutliche Reduzierung der Kosten in der Arzneimittelentwicklung.
Medikamentenentwicklung im Aufwind
Weil immer mehr Firmen diese beschleunigten Verfahren anstreben, bereiten sich die Regulierungsbehörden auf eine Flut neuer medizinischer Anwendungen vor. In diesem Jahr dürfte die FDA die AVXS-101 genannte Gentherapie zur Behandlung der Muskelkrankheit SMA bei Kindern zulassen. Sie könnte das Leben der kleinen Patienten grundlegend verbessern, denn SMA ist weltweit die häufigste genetisch bedingte Ursache für Kindersterblichkeit (3). Zudem könnte sie zu einer Plattform für andere Gentherapien werden. Das dürfte einer der zentralen Gründe sein, warum sich Novartis im letzten Jahr die Übernahme von AveXis, das AVXS-101 entwickelt hat, ganze 8,7 Milliarden Dollar kosten liess. Bis 2025, so schätzt die FDA, wird sie 10 bis 20 Gen- und Zelltherapien pro Jahr die Zulassung erteilen (4).
Auch andere Verfahren zur Bekämpfung von Krankheiten werden auf den Markt kommen. Letztes Jahr gab die amerikanische Arzneimittelbehörde grünes Licht für Onpattro, das erste RNA-Interferenz (RNAi)-Therapeutikum zur Behandlung peripherer Nervenerkrankungen. RNAi nutzt die eigene DNA-Sequenz eines Gens, um zielgerichtet pathogen veränderte Gene stumm zu schalten. Durch Stilllegung dieser Gen-Sequenz kann Onpattro das Fortschreiten dieser schmerzhaften Erberkrankung möglicherweise aufhalten oder sogar heilen. Andere neuartige Therapien könnten sich als ähnlich wirksam erweisen. So gibt es beispielsweise Gentherapien, die ein fehlendes bzw. defektes Gen ersetzen können. In die Zelle implantiert, produziert das hergestellte Gen ein Protein, das bisher bei einem Patienten gefehlt haben und nun die Krankheit heilen könnte. Bei Krebs wiederum werden mit Immuntherapien grosse Fortschritte erzielt. Diese Behandlungsmethoden beinhalten die Unterbrechung von Inhibitoren, die das Immunsystem daran hindern, Krebszellen zu erkennen beziehungsweise es ihm ermöglichen, T-Zellen (eine Art Immunzelle) umzuprogrammieren, damit diese die Krebszellen attackieren und abtöten. Die Ergebnisse sind beeindruckend: Allein die Immuntherapie Keytruda von Merck & Co. senkt das Mortalitätsrisiko bei einer der häufigsten Lungenkrebsarten um 50 Prozent.
Den Wert im Fokus
So aufregend derartige Erfolge sind: Anleger sollten nicht vergessen, dass es auch eine Kehrseite der Medaille gibt. Zum einen haben Untersuchungen ergeben, dass rund 90 Prozent der neuen Wirkstoffe, die an Menschen getestet wurden, nicht zur Marktreife gelangen. Zum anderen zeigt unsere Erfahrung, dass Anleger bei erfolgreichen Therapieformen in rund 90 Prozent der Fälle das kommerzielle Potenzial über- bzw. unterschätzen. Diese Unwägbarkeiten können dramatische Kurssprünge bei Biotech-Aktien auslösen.
Anleger sollten deshalb unseres Erachtens die Bewertung in den Mittelpunkt stellen und nach Aktien suchen, in deren Kurs das in den Produkten und der Pipeline eines Unternehmens schlummernde wissenschaftliche und kommerzielle Potenzial nur unzureichend eingepreist ist. Nach dem Kursrutsch Ende letzten Jahres sind etliche Biotech-Aktien aus unserer Sicht nun attraktiv bewertet, was vermehrte Fusionen und Übernahmen nach sich ziehen könnte. Tatsächlich wurden allein im Januar bereits Transaktionen in der Biotech-Branche im Wert von über 80 Milliarden Dollar angekündigt, unter denen die geplante Übernahme von Celgene durch Bristol-Myers Squibb hervorsticht.
Anlegern empfehlen wir ausserdem, nach Firmen Ausschau zu halten, die Medikamente mit Mehrwert für das Gesundheitssystem entwickeln. Das Institute for Clinical and Economic Review, ein unabhängiges Forschungsinstitut in Boston, Massachusetts, spielt eine zunehmend wichtige Rolle bei der Beurteilung des klinischen und ökonomischen Werts neuer Medikamente. Wir sind überzeugt, dass Unternehmen künftig den Mehrwert ihrer Arzneimittel unter Beweis stellen müssen, wenn für diese eine hohe Kostenrückerstattung gewährt werden soll.
Dieser Wert könnte noch stärker in den Fokus rücken, denn immer mehr Länder arbeiten daran, die mit alternden Bevölkerungen und höherem Lebensstandard steigenden Gesundheitskosten in den Griff zu bekommen. 2017 aktualisierte China beispielsweise seine Liste der erstattungsfähigen Medikamente und Therapien im Rahmen des staatlichen Krankenversicherungsprogramms, das nahezu 100 Prozent der chinesischen Bevölkerung abdeckt. Bei dieser ersten Aktualisierung seit 2009 wurden mehr als 300 neue Medikamente in die Liste aufgenommen. China hat unlängst zudem Immuntherapien von Merck und Bristol-Myers zugelassen. Erste Daten legen nahe, dass die Markteinführung dieser Krebsmedikamente in China mit der rasanten Verbreitung in den USA Schritt halten kann. Eine derart starke Nachfrage könnte das beeindruckende Wachstum der Biotech-Branche weiter anheizen und den Unternehmen helfen, neue hochwertige Medikamente zu entwickeln.
Quellenangaben:
1
https://www.fda.gov/Drugs/DevelopmentApprovalProcess/DrugInnovation/ucm592464.htm
2
https://migraineresearchfoundation.org/about-migraine/migraine-facts/
3
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5823674/
4
https://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm629493.htm
Die Gesundheitsbranche unterliegt unterschiedlicher staatlicher Regulierung und Rückerstattungssystemen, und ihre Produkte und Dienstleistungen unterliegen der staatlichen Zulassung, was erheblichen Einfluss auf deren Preise und Verfügbarkeit haben kann. Zudem können ihre Produkte schnell veralten und ihr Patentschutz kann auslaufen.
Die vorstehenden Einschätzungen sind die des Autors zum Zeitpunkt der Veröffentlichung und können von denen anderer Personen/Teams bei Janus Henderson Investors abweichen. Die Bezugnahme auf einzelne Wertpapiere, Fonds, Sektoren oder Indizes in diesem Artikel stellt weder ein Angebot oder eine Aufforderung zu deren Erwerb oder Verkauf dar, noch ist sie Teil eines solchen Angebots oder einer solchen Aufforderung.
Die Wertentwicklung in der Vergangenheit ist kein zuverlässiger Indikator für die künftige Wertentwicklung. Alle Performance-Angaben beinhalten Erträge und Kapitalgewinne bzw. -verluste, aber keine wiederkehrenden Gebühren oder sonstigen Ausgaben des Fonds.
Der Wert einer Anlage und die Einkünfte aus ihr können steigen oder fallen. Es kann daher sein, dass Sie nicht die gesamte investierte Summe zurückerhalten.
Die Informationen in diesem Artikel stellen keine Anlageberatung dar.
Zu Werbezwecken.
Janus Henderson Investors ist der Name, unter dem Anlageprodukte und -dienstleistungen von Janus Capital International Limited (Registrierungsnummer 3594615), Henderson Global Investors Limited (Registrierungsnummer 906355), Henderson Investment Funds Limited (Registrierungsnummer 2678531), AlphaGen Capital Limited (Registrierungsnummer 962757), Henderson Equity Partners Limited (Registrierungsnummer 2606646) (jeweils in England und Wales mit Sitz in 201 Bishopsgate, London EC2M 3AE eingetragen und durch die Financial Conduct Authority reguliert) und Henderson Management S.A. (Registrierungsnummer B22848 mit Sitz in 2 Rue de Bitbourg, L-1273, Luxemburg, und durch die Commission de Surveillance du Secteur Financier reguliert) zur Verfügung gestellt werden.
Janus Henderson, Janus, Henderson, Perkins, Intech, Alphagen, VelocityShares, Knowledge. Shared and Knowledge Labs sind Marken von Janus Henderson Group plc oder einer ihrer Tochtergesellschaften. © Janus Henderson Group plc.